LC-MS/MS Mycotoxin-Analytik in Bier mit Hilfe eines Shimadzu LCMS-8050 Triplequadrupol-Massenspektrometers
Analyse von Mycotoxinen (Deoxynivaneol und Deoxynivaneol-3-Glycosid) mit Stabilisotopenverdünnung
Modifizierte Mycotoxine, wie beispielsweise Glycoside von Fusarien-Toxinen, gewinnen zunehmend an Aufmerksamkeit aufgrund ihres verbreiteten Vorkommens in Getreide und Getreideprodukten sowie ihrer potenziellen Toxizität. Außerdem stellen sie, weil Standards fehlen, eine Herausforderung für die LC-MS/MS Analytik dar. Es wurden entsprechende Standards synthetisiert und eine Stabilisotopenverdünnungsanalyse mit LC-MS/MS zur sensitiven und präzisen Analytik zweier relevanter Mycotoxine (Deoxynivaneol und Deoxynivaneol-3-Glycosid) in Bier entwickelt.
Fusariose stellt Gefahr für Getreide dar
Fusarien-Spezies sind ubiquitär vorhanden und können eine Vielzahl verschiedener Getreide befallen. Verschiedene Krankheitsbilder können die Folge sein, die unter dem Begriff Fusariose zusammengefasst werden. Hierzu gehören Weiß- und Taubährigkeit sowie Schrumpfkörner. Fusariose kann zu starken Ernteminderungen führen und die Qualität des Getreides beeinträchtigen. Außerdem kann der Verzehr von befallenem Getreide erhebliche gesundheitliche Risiken bergen. Zu den gebildeten Fusarien-Toxinen gehören verschiedene Gruppen, wie Fumonisine, Enniatine, Zearalenone und Trichothecene. Zu letzteren zählen Deoxynivaneol (DON) sowie dessen modifizierte Form DON-3-Glycosid (D3G), die beide ein erhebliches gesundheitliches Risiko für Mensch und Tier darstellen. Grenzwerte für modifizierte Mycotoxine wurden bisher nicht definiert. Für DON liegen sie bei 1.250 µg/kg in unverarbeiteten Lebensmitteln [1]. Daten zur Toxizität und Exposition fehlen, allerdings ist bekannt, dass D3G im Gastrointestinaltrakt zu DON hydrolysiert wird [2].
Modifizierte Mycotoxine übersteigen den normalen Umfang der Routineanalytik und werden häufig unabsichtlich nicht berücksichtigt. Allerdings wurde D3G bereits in vielen Getreiden und Gerstenmalzproben beobachtet und übersteigt beispielsweise in Bier sogar den Gehalt der unmodifizierten Form [3]. Dies zeigt die dringende Notwendigkeit einer umfangreichen Risikobewertung. Vor diesem Hintergrund wurde ein stabilisotopenmarkierter Standard für D3G synthetisiert und eine Stabilisotopenverdünnungsanalyse (SIVA) für die Analytik in Bier entwickelt sowie validiert.
Methodenentwicklung
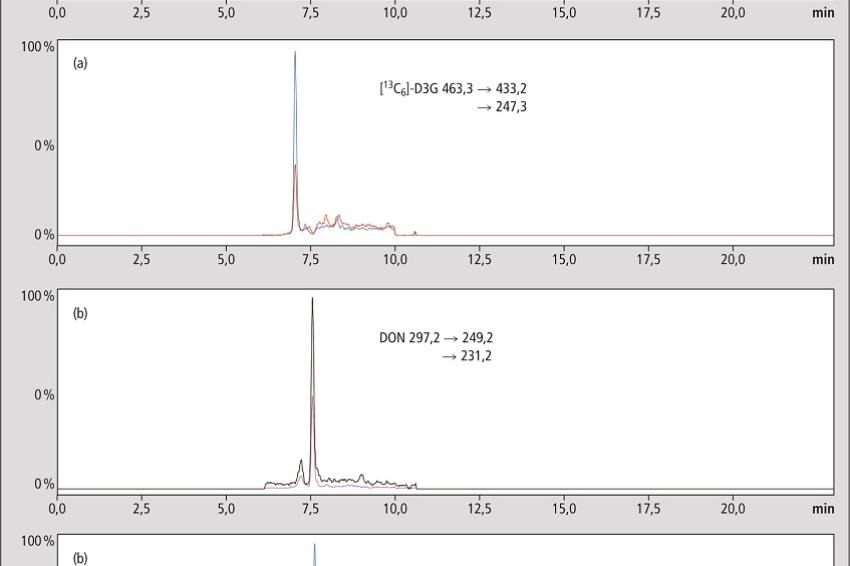
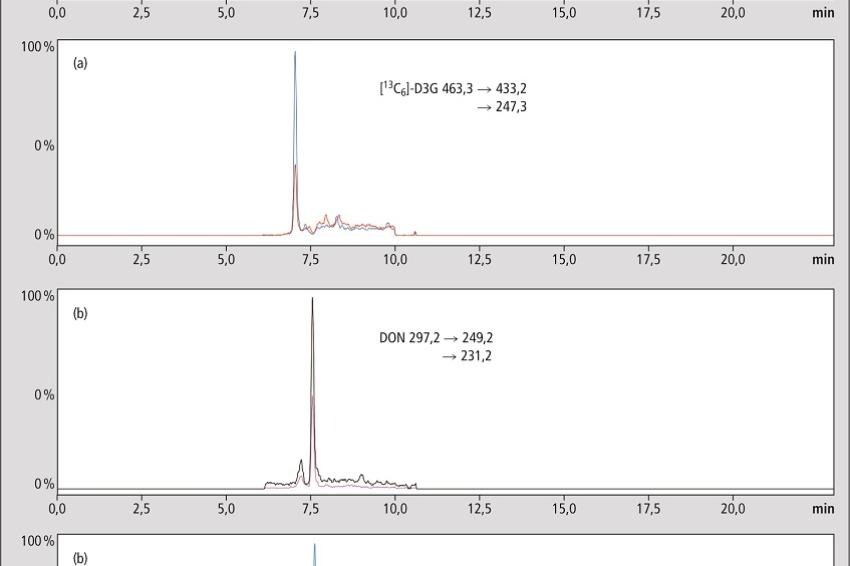
Die Analytik wurde auf einem LC-MS/MS (Typ: LCMS-8050 Triplequadrupol-Massenspektrometer, Hersteller: Shimadzu Deutschland GmbH, Duisburg) durchgeführt. DON und dessen interner Standard [13C15]-DON werden im positiven ESI-Modus gemessen. Die protonierten Moleküle [M+H]+dienen dabei als Precursor. D3G hingegen wird im negativen ESI-Modus gemessen mit [M-H]- als Precursor. Die Fragmentierungsmuster von D3G und dessen synthetisiertem stabilisotopenmarkiertem internem Standard sind in Abb. 1 zu sehen.
Im positiven Modus findet verstärkt eine Quellenfragmentierung des Glycosids statt, wodurch Glycosid und Aglycon nicht mehr zu unterscheiden sind. Aus diesem Grund ist für eine individuelle Quantifizierung von DON eine Basislinientrennung von DON und D3G entscheidend. Die erforderliche Trennung wurde auf einer Hydrosphere-RP-C18 Säule (YMC Europe GmbH, Dinslaken) mit einem verhältnismäßig flachen Gradienten erreicht (11,25 % Acetonitril pro Minute, [5]).
Eine simultane Messung von positiven und negativen Übergängen in einem Lauf ist durch eine sogenannte „Bypass“-Stromversorgung auf dem LCMS-8050 ohne Sensitivitätsverlust möglich. Die patentierte Technologie von Shimadzu sorgt nach sehr kurzer Zeit für ein stabiles Spannungsniveau, das reproduzierbare Signalflächen bereits nach 5 ms Umschaltzeit ermöglicht.
Leider machte hier die Praxis einen Strich durch die Rechnung und die für DON im positiven Modus erforderliche Säure unterdrückte das Signal des Glycosids im negativen sowie umgekehrt. Um beide Substanzen mit maximaler Empfindlichkeit zu messen, wurden zwei separate Läufe durchgeführt. Für DON im positiven Modus mit Zusatz von Ameisensäure und für das Glycosid im negativen Modus ohne Zusätze in der mobilen Phase. Ein Multiplexing System, wie die Nexera MX (Shimadzu Deutschland GmbH, Duisburg), die zwei unabhängige Flusslinien führt und somit beide Methoden verschachtelt, könnte den Zeitverlust zweier separater Läufe ausgleichen. Die LC-MS/MS Chromatogramme der Bierproben zeigten geringes Rauschen und die Signale interferierten nicht mit Analyten oder internen Standards.
Validierung
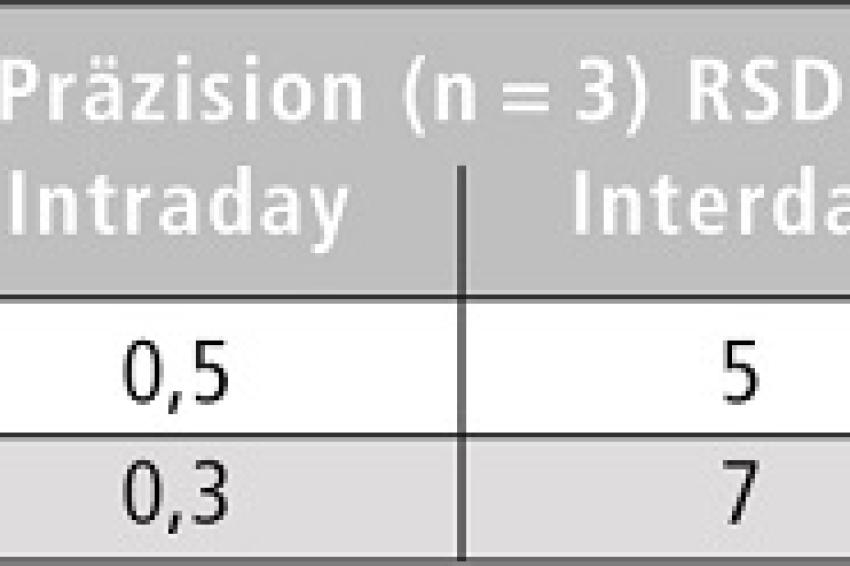
Eine ausführliche Validierung massenspektrometrischer Methoden spielt eine entscheidende Rolle für die Interpretation analytischer Ergebnisse. Hierzu wurden Nachweis- (LOD) und Bestimmungsgrenzen (LOQ), die Präzision sowie die Wiederfindung in Bier-Matrix bestimmt. Die Ergebnisse finden sich in Tabelle 1. Die Methode ist sensitiv genug, um trotz kleiner Probenmengen, welche Matrixeffekte minimieren, ausreichend niedrige LOQs zu erreichen. Durch die Verwendung des stabilisotopenmarkierten internen Standards werden Wiederfindungen von 100 ± 15 % erreicht.
Analyse von Bierproben
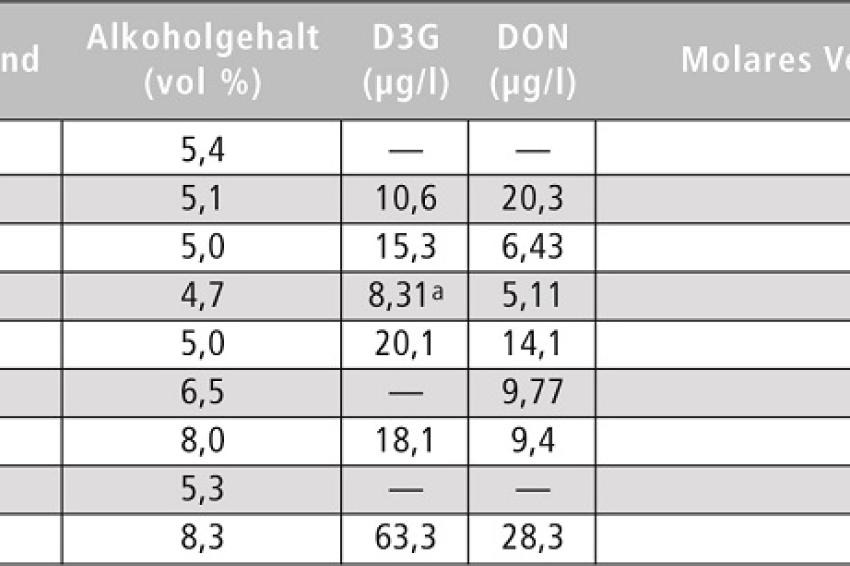
Bei der Analyse von Bierproben (Tabelle 2) zeigte sich, dass etwa 80% der Proben mit D3G und 90% der Proben mit DON kontaminiert waren. Mit einer Ausnahme lagen die Gehalte unter 20 µg/l. Der höchste Gehalt wurde bei einem amerikanischen Bier gefunden und lag bei 63 µg/l D3G und 28 µg/l DON. Umgerechnet aus den Grenzwerten für den Rohstoff Getreide würde für DON ein Grenzwert von 225 µg/l in normalem Lager-Bier resultieren (1250 µg/kg x 18%). Die hier ermittelten Werte überschreiten diesen Grenzwert nicht. Mit der hier vorgestellten Methode für die Analyse von DON und D3G in Bier, die auch für Gerstenmalz oder verschiedene Getreide anwendbar ist, ist es möglich, exakte und ausreichende Expositionsdaten zu generieren, die in Zusammenhang mit Werten zur Toxizität für eine umfangreiche Risikobewertung eingesetzt werden können.
Referenzen
[1] The Commission of the European Communities. Commission Regulation (EC) No. 1881/2006 of 19 December 2006 setting maximum levels for certain contaminants in foodstuffs, Official Journal of the European Union (2006)
[2] Berthiller, F., et al., Toxicological Letters 206, 264–267 (2011).
[3] Varga, E., et al., Food Additives & Contaminants Part A 30, 137–146 (2013).
[4] Habler, K. et al., Molecules 21, 838 (2016).
[5] Habler, K., Analytical and Bioanalytical Chemistry 408, 307–317 (2016).