HPLC-Spurenanalytik von Tierarzneimitteln
Tetracyclinrückstände in Lebensmitteln schnell quantifizieren
Ein seit Jahrzenten bekanntes Problem ist der exzessive Einsatz von Antibiotika in der Tierhaltung und die daraus für die Umwelt resultierenden Folgen. Trotz starker Bestrebungen der letzten Jahre in Richtung einer sorgfältigeren und verantwortungsvolleren Anwendung, sind die Verordnungsmengen immer noch sehr hoch [1, 2]. Um die behördlichen Rückstandshöchstmengen sicher nachweisen können, sind immer wieder neue innovative Analytik-Methoden erforderlich.
Im Jahr 2020 wurden allein in Deutschland 701 t Antibiotika von pharmazeutischen Unternehmen an Tierärzte abgegeben. Wie auch in den vorangegangenen Jahren waren die beiden Wirkstoffklassen Penicilline (278 t) und Tetracycline (148 t) die Spitzenreiter [1]. Trotz der Vermeidungsstrategien der EMA [2] mit dem Ziel des sorgfältigen und verantwortungsvollen Einsatzes von Antibiotika bei Tieren in Europa ist deren Verbrauch in Deutschland im Jahr 2020 erstmals seit 2011 wieder gestiegen. Die breite Anwendung von Antibiotika in der Tiermast hat nicht nur das Ziel der Prävention und Heilung von Krankheiten.
Gerade Tetracycline werden bevorzugt als Zusatzstoffe in Tierfutter verwendet, da sie ein schnelles Wachstum und eine schnelle Gewichtszunahme fördern [3]. Bei der Verwendung in der Veterinärmedizin werden Tetracycline hauptsächlich über den Urin ausgeschieden. Darüber hinaus erfolgt eine Exkretion in Milch und Eier sowie eine Anreicherung im Gewebe [4]. Diese verbreitete Anwendung von Tetracyclinen und deren Eintrag in die Umwelt führt zu spezifischen Problemen für den Menschen. Durch die übermäßige Freisetzung von Antibiotika in subtherapeutischen Mengen können Resistenzen gegenüber Krankheitserregern entstehen [5]. 2019 gab es weltweit knapp 5 Millionen Todesfälle im Zusammenhang mit Erregerresistenzen. Damit ist dies eine der häufigsten Todesursachen weltweit [6]. Antibiotika-Rückstände in der Umwelt stellen auch darüber hinaus schwerwiegende Risiken für den Menschen dar, wie beispielsweise allergische Reaktionen, Leberschäden oder Magen-Darm-Störungen [7].
Milch, Milchprodukte und Eier sind eine tragende Säule für eine gesunde und ausgewogene Ernährung. Aus diesem Grund befassen sich über 50 % der publizierten Methoden zur Lebensmittelanalytik von Tetracyclinen mit dieser Gruppe von Nahrungsmitteln [7]. Aber auch Fleischerzeugnisse, Honig und Fisch zählen für einen Großteil der Menschen zur täglichen Ernährung und können ebenfalls mit Tetracyclinen verunreinigt sein. Aufgrund der Gefahren, die eine übermäßige und unkontrollierte Aufnahme von Antibiotika aus diesen Lebensmitteln birgt, wurde die erlaubte Menge an Tetracyclinen in Lebensmitteln begrenzt. Die Europäische Union hat beispielsweise eine Rückstandshöchstgrenze von 0.1 mg·kg-1 und die FDA von 0.3 mg·kg-1 für Tetracyclin (TC), Oxytetracyclin (OTC) und Chlortetracyclin (CT) in Milch festgelegt [8, 9]. Trotz dieser Höchstmengenbegrenzung ist eine schädliche Wirkung auf den menschlichen Organismus nicht auszuschließen, daher ist eine routinemäßige Kontrolle der Grenzwerte sowie eine Bestimmung der absoluten Tetracyclinverunreinigung auch in Bereichen unterhalb der Rückstandshöchstgrenze sehr wichtig. Um diese Untersuchungen schnell und sicher durchführen zu können, sind immer wieder neue und verbesserte Probenvorbereitungs- und Analysemethoden notwendig.
Herausforderungen und Ziele der Lebensmittelanalytik
Das Hauptziel des Analyseverfahrens ist eine robuste Methode, welche zeitsparend und kostengünstig eine Vielzahl verschiedener Tetracycline mit nur einer Messung quantifizieren kann. Eine Möglichkeit, dies zu erreichen, ist der Einsatz von immer empfindlicheren und spezifischeren Detektoren. So brachte der Einsatz der LC-MS/MS in den 2000er Jahren einen Durchbruch in der Messung immer niedrigerer Konzentrationsniveaus. Einige Einschränkungen der LC-MS können durch die hochauflösende Quadrupol-Time-of-flight-Massenspektrometrie (Q-TOF) umgangen werden [10]. Der Einsatz hochentwickelter Detektoren mit dem Ziel, eine immer geringere Nachweis- und Bestimmungsgrenze zu erreichen, hat den Nachteil der hohen Anschaffungs-, Betriebs- und Energiekosten dieser hochtechnologisierten Geräte. Im Bereich der chromatografischen Effizienz besitzt die fortschrittlichere UHPLC Vorteile gegenüber der HPLC, was maximale Trennleistung in kürzester Zeit betrifft. Allerdings liegen die Anschaffungskosten für eine HPLC-Anlage deutlich unter denen für eine UHPLC-Anlage. Darüber hinaus können die Kosten für den Betrieb einer UHPLC-Anlage im direkten Vergleich das Doppelte betragen [11].
Eine nachhaltige Lebensweise gewinnt in der Gesellschaft immer mehr an Bedeutung. Ziel sollte es deshalb sein, die Vorteile hochentwickelter instrumentell-analytischer Geräte für komplexe Fragestellungen und Spezialanalytik zu nutzen. Bei einer Hochdurchsatz- Routineanalytik sollte, wenn mit validen Ergebnissen möglich, die ressourcensparende und damit umweltschonendere Standardanalytik bevorzugt werden. Diese hat darüber hinaus den Vorteil der breiten Anwendbarkeit, da nur Standard-Laborequipment benötigt wird.
Die Untersuchung von Lebensmittelproben erfordert nicht nur eine präzise Analytik, sondern auch eine entsprechend validierte Probenvorbereitung zur Abtrennung der Matrixkomponenten. Ziel ist es hierbei, eine Methode zu entwickeln, die für viele verschiedene Matrices anwendbar und gleichzeitig einfach, schnell und umweltfreundlich ist.
Probenvorbereitungsmethoden
Die Extraktion von Tetracyclinen aus Lebens- und Futtermitteln ist nach wie vor eine Herausforderung, da die verschiedenen Matrixeffekte dabei ein großes Problem darstellen. Die am häufigsten verwendeten Probenvorbereitungsarten sind die Flüssigextraktion (liquid extraction, LE) und die Festphasenextraktion (solid-phase extraction, SPE). Der Vorteil der SPE liegt in der Möglichkeit, sehr verdünnte Proben aufzukonzentrieren. Nachteilig bei dieser Methode ist der relativ hohe Kosten-, Lösungsmittel- und Zeitaufwand, sowie die im Vergleich geringere Reproduzierbarkeit aufgrund der chargenbedingten Schwankungen der Säulenfüllmaterialien [7]. Die LE ist selektiver und robuster als die SPE, bei etwas niedrigerem Lösungsmittelverbrauch. Jedoch ist hierbei ein zeit- und energieaufwendiges Evaporieren der Probe erforderlich [7]. Eine Weiterentwicklung der LE ist mit der QuEChERS-Methode (quick, easy, cheap, effective, rugged, and safe) gelungen. Sie ist ursprünglich basierend auf einer Flüssig-Flüssig-Verteilung in Acetonitril/Wasser, bei der Salze zur Verbesserung der Phasentrennung zugegeben werden [12]. Die Extraktionsbedingungen müssen auf die jeweilige Matrix und nachzuweisende Stoffklasse angepasst werden.
Quantifizierung mittels HPLC
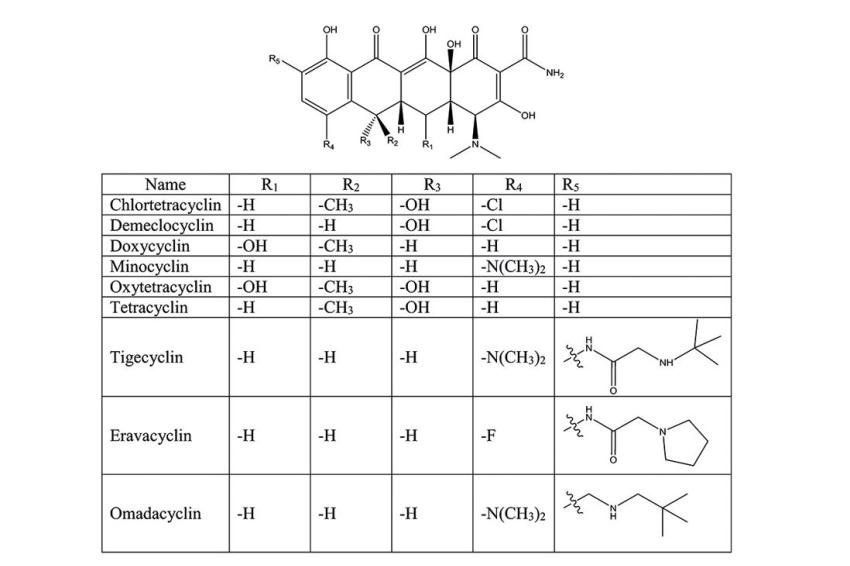
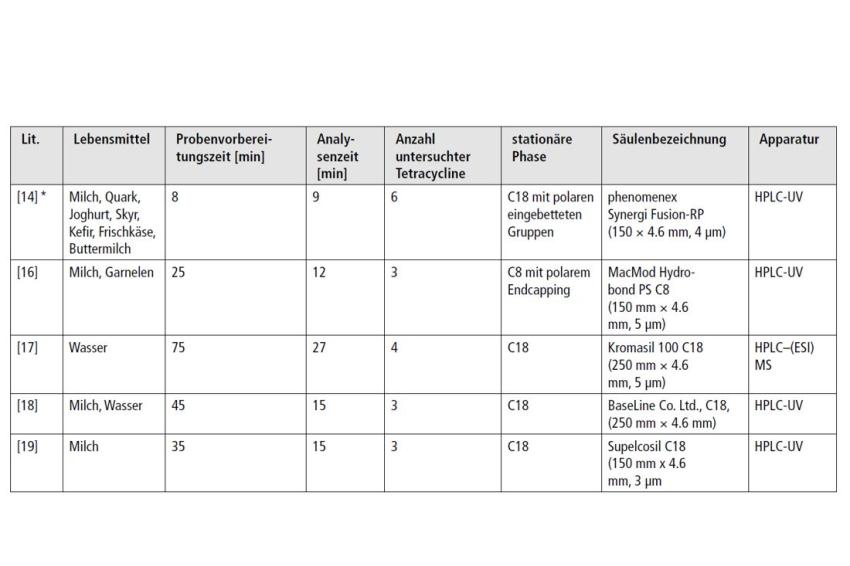
HPLC-Analytik ist die am häufigsten verwendete Technik zum Nachweis von Tetracyclinen in Lebensmitteln [7]. Eine chromatographische Trennung dieser Substanzklasse in kurzer Zeit ist komplex, da sich die einzelnen Derivate strukturell sehr ähneln. Die Grundstruktur der Tetracycline ist ein Octahydronaphthacen-Ringsystem, welches sich je nach Derivat nur durch Substituenten in vier verschiedenen Positionen unterscheidet (Abb. 1). Die vielen polaren Gruppen bedingen die gute Wasserlöslichkeit, weshalb ein hoher wässriger Anteil der mobilen Phase Voraussetzung für ein RP-Trennung ist. Der pH-Wert der mobilen Phase ist ein entscheidender Faktor für die Güte der Trennung, da die Substanzen eine saure vinyloge Carbonsäure, eine enolisches Hydroxylfunktion sowie eine, respektive zwei, basische Dimethylaminogruppen enthalten. Darüber hinaus ist die Stabilität der Tetracycline in wässriger Lösung ebenfalls stark pH-abhängig. Das Stabilitätsoptimum liegt bei pH 2,5. Bei höheren pH-Werten tritt eine zügige Zersetzung ein [13]. Tetracycline sind starke Komplexbildner, welche mit zwei- und dreiwertigen Metallkationen Chelatkomplexe bilden. Die Intensität der Komplexbildung nimmt ebenfalls mit steigendem pH-Wert zu. Die Komplexierung über das Phenol-Diketon-System (Position C10-C12) erfolgt im pH-Bereich 3-7,5. Bei darüber hinaus steigendem pH-Wert kann durch die Deprotonierung der Dimethylaminogruppe gemeinsam mit der benachbarten cis-ständigen Hydroxygruppe (Position C12a) eine weitere Komplexierung erfolgen [13]. Diese Komplexierungstendenz hat in der Vergangenheit zu Schwierigkeiten bei der chromatografischen Trennung (starkes Tailing, Adsorption auf der Säule) geführt und den Zusatz von stärkeren Chelatbildnern, wie Ethylendiamintetraessigsäure (EDTA) oder Oxalsäure, zur mobilen Phase nötig gemacht. Moderne Kieselgelsäulen weisen nur noch eine sehr geringe Metallionenkontamination auf, weshalb bei entsprechender Auswahl der Säule, keine komplexbildenden Zusätze zum Fließmittel mehr nötig sind. Zur Quantifizierung eines Tetracyclins ist eine Standard RP-18 oder RP-8 Säule gut nutzbar. Sollte jedoch die Trennung mehrerer Tetracycline in kurzer Analysezeit angestrebt werden, sind modifizierte Füllmaterialen zu bevorzugen, beispielsweise die Verwendung von polar-endcapped Säulen. Diese bieten durch die eingebetteten polaren Gruppen eine polare und gleichzeitig hydrophobe Selektivität, wodurch eine bessere Retention polarer organischer Verbindungen erreicht wird. Es gibt eine große Vielzahl von Publikationen, welche sich mit Rückstandsbestimmung von Tetracyclinen in verschiedenen Lebensmitteln befassen. Tab. 1 zeigt exemplarisch eine Übersicht ausgewählter Säulen, die Anzahl der getrennten Tetracyline und deren resultierende Analysenzeiten. Außerdem ist angegeben, zur Untersuchung welcher Lebensmittel die Methode entwickelt wurde und welche Extraktionszeit benötigt wird, um eine injektionsfertige HPLC-Probe zu erhalten.
Fazit
Trotz intensiver Forschung auf diesem Gebiet sind Multirückstandsmethoden, die gleichzeitig mehr als ein Tetracyclin in Milch und anderen Matrices innerhalb einer extrem kurzen Probenvorbereitungszeit bestimmen, noch selten. Die in Tab. 1 vorgestellte Extraktionsmethode [14] kombiniert erstmals eine ultraschnelle, ressourcensparende Microextraktion, die auf verschiedene Milchprodukte anwendbar ist, mit einer schnellen und reproduzierbaren Quantifizierung von sechs Tetracyclinen mittels HPLC-UV. Die hohen Wiederfindungsraten in unterschiedlichen Matrices zeigen, dass die Methode auch für weitere Lebensmittel adaptiert werden kann.
Literatur: https://bit.ly/GIT-Zergiebel
Downloads
Contact
Universität Jena
Fraunhoferstr. 6
07743 Jena
+49 3641 9300