Emulsionsbildung mit geringem Energieeintrag
Bildung von Mikropartikeln mit gesundheitsfördernden Komponenten unter schonenden Bedingungen
Für die Emulsionsbildung stehen Rotor-Stator-Dispergier- und Hochdruckhomogenisier-Techniken zur Verfügung, mit denen die Erzeugung von Mikrotropfen sehr gut gelingt. Dies geschieht im Allgemeinen unter hohem Energieeintrag, hierunter leiden jedoch scher-, druck- und temperaturempfindliche Inhaltsstoffe. Ein hoher Energieeintrag ist demzufolge weniger geeignet, wenn Emulsionsprodukte oder Mikropartikel mit Nutrazeutikal bzw. für Functional Food erzeugt werden.
Zur Erzeugung feindispergierter angereicherter Lebensmittel unter Zusatz von Vitaminen, Omega-3-Fettsäuren, Antioxidantien, Probiotika usw., sowie mit speziellen Nutrazeutikal (z. B. bioaktive chemische Verbindungen, die krankheitsvorbeugende und sonstige medizinisch wirksame Eigenschaften aufweisen [1]), können inzwischen geeignetere Verfahren genutzt werden. Diese üben keinen negativen Einfluss auf scher-, druck- oder temperaturempfindliche Komponenten aus, bzw. biologisch aktive Stoffe verlieren nicht ihre Aktivität. Derartige Verfahren gewinnen daher für die Erzeugung von Emulsionen, Mikropartikel und Mikrokapseln mit gesundheitsfördernden Komponenten zunehmend an Bedeutung.
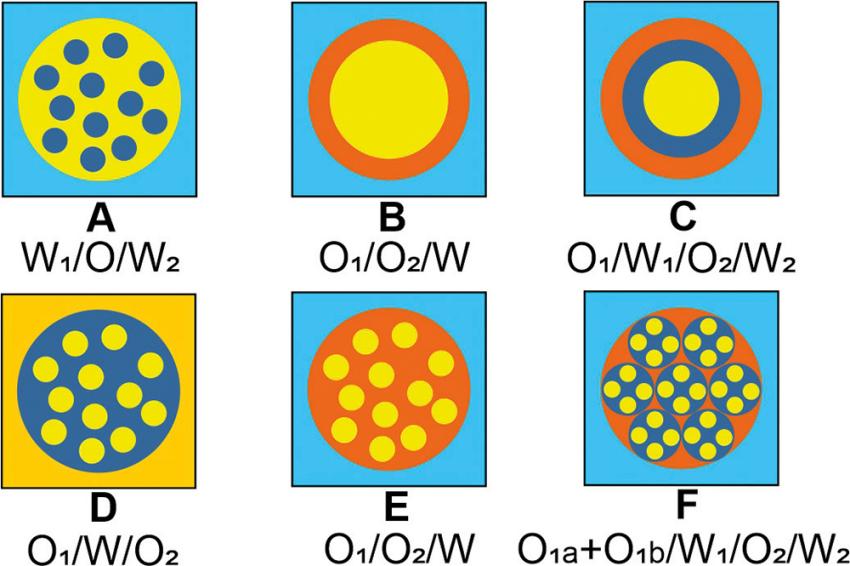
Für den schonenden Einschluss von empfindlichen und sonstigen, die Lebensmittelqualität verbessernden Inhaltsstoffen bieten sich einfache, Doppel- und multiple Emulsionen sowie Mikrogele und Mikrokapseln an (Abb. 1). Diese können die Stabilität der eingeschlossenen Komponenten in Lebensmittelsystemen und bei der Nahrungsaufnahme erhöhen, eine Voraussetzung zum Erstellen von Dosis-Wirkungs-Beziehungen für epidemiologische Studien [2]. Die Bildung derartiger Emulsionen und Mikropartikel ermöglichen das Membranemulgieren und die Mikrofluidik-Technik [3], hierüber wird nachfolgend ein Überblick gegeben. Ausführliche Informationen hierzu (mit einer umfangreichen Literaturübersicht) liefert die 2. Auflage des Buches „Multiple Emulsionen“ (Behr´s Verlag, 2022) [4].
Partikuläre Systeme zum Einschluss von Nutrazeutikal
Der Einschluss empfindlicher Inhaltsstoffe kann in Doppelemulsionen (Abb. 1, A, B, D, E) und multiplen Emulsionen (Abb. 1, C, F) erfolgen. Diese sind zugleich ein Intermediat für die Bildung von Mikrogelen und einfacher oder mehrschichtiger Kapseln (Abb. 1, B, C). Während die Varianten A, D und E Beispiele für flüssige Systeme sind, zeigen die Varianten B und C den möglichen Aufbau von Mikrokapseln durch hydrophobe O2-Phasen. Für die Varianten A, D und E können die feindispersen Tropfen der Innenphase und die größeren Tropfen der mittleren Phase mittels Membranemulgieren erzeugt werden. Eine definierte Einzeltropfenbildung (Varianten B, C und F) ermöglicht die Mikrofluidik-Technik. Die Variante F zeigt die Möglichkeit des Einschlusses von Einzeltropfen mit verschiedenen Komponenten in multiple Emulsionstropfen, ebenfalls realisiert mit der Mikrofluidik-Technik.
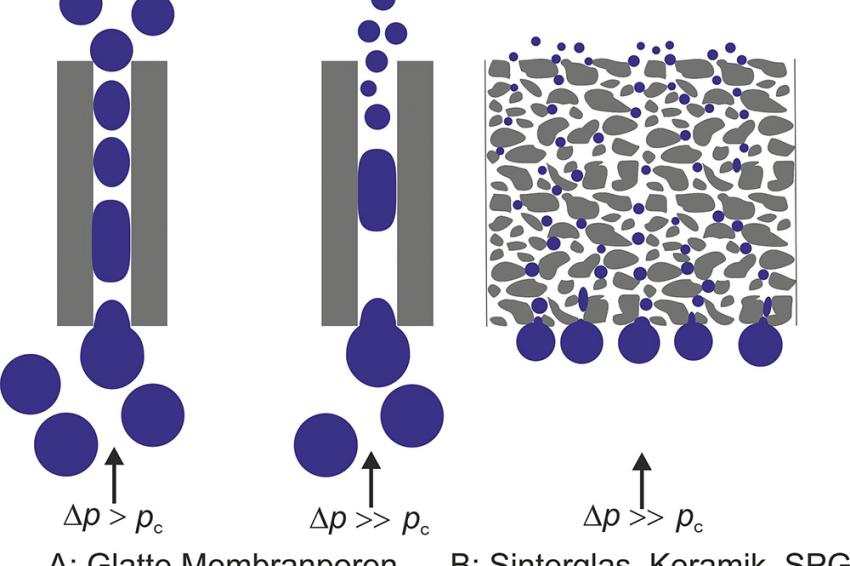
Membranemulgierverfahren
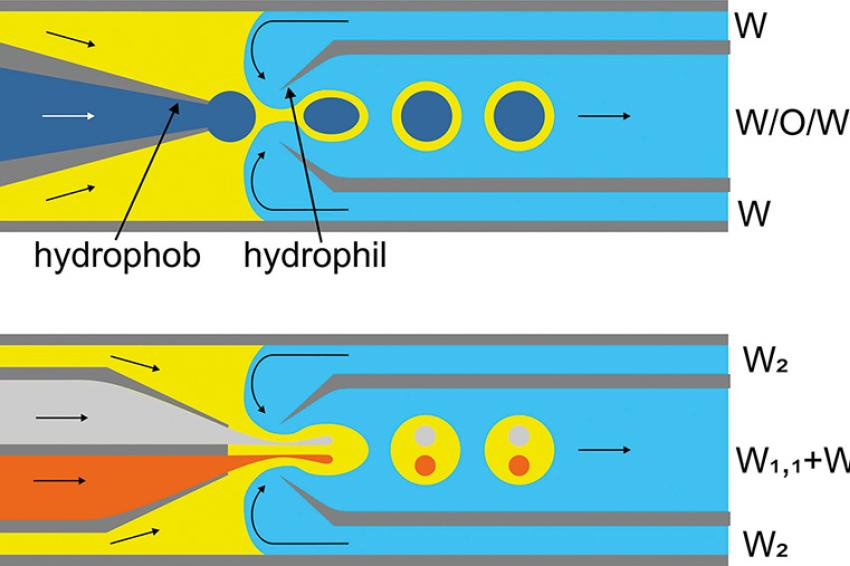
Hiermit können schonend fein- und grobdisperse Emulsionen mit enger Tropfenverteilung erzeugt werden. Es stehen Dünnschicht- und Rohrmembranen verschiedener Materialien zur Verfügung, die erzeugten Tropfen können einen Größenbereich von ~0,3 – 100 µm mit einer Standardabweichung von 10 – 15 % aufweisen. Wichtige Parameter für die Tropfengröße sind u. a. Porengestaltung, Porenweite der Membran, Flux, Viskosität der Dispersphase, Grenzflächenspannung zwischen den Phasen sowie Kontaktwinkel Dispersphase/Membranoberfläche. Von wesentlicher Bedeutung ist beim direkten Membranemulgieren die Wandschubspannung der kontinuierlichen Phase, die durch Rotation von Rohrmembranen erhöht werden kann.
Während ein hoher Flux beim direkten Emulgieren zu größeren Tropfen und zur Zunahme der Polydispersibilität führen kann, ist dies beim Premix-Membranemulgieren nicht der Fall. Hierbei wird ein schonend gebildeter Emulsionspremix mit hohem Flux durch eine Membranschicht mit hoher Tortuosität gepresst (Schichtdicke der Monokanalmembran z. B. 0,8 mm oder 2 mm). Die Scherkräfte derart gestalteter Membranporen führen zur weiteren Tropfenzerkleinerung. So können z. B. O/W-Emulsionen mit 260 nm Tropfengröße mit einer Membran aus mikroporösem Glas (0,2-µm-Porenweite) bei einem Flux von ~2,9 m3m-2h-1 erzeugt werden [6]. In Abhängigkeit von der Viskosität der W- und O-Phase kann der Flux beim Dispergieren des Premix bis zu Jd = 60 m3m-2h-1 betragen [7]. Weitere Membrantypen und Möglichkeiten zum Erzielen monodisperser Emulsionen (z. B. Sieb mit Glaskügelchenschicht) werden bei [4] beschrieben.
Derartige feindispergierte Emulsionen (Typ O/W und W/O) eignen sich als Einschlussmedien für hydrophobe oder hydrophiler Komponenten in Doppelemulsionen vom Typ O/W/O der W/O/W. Das Dispergieren der O/W- oder W/O-Emulsion in eine weitere Phase kann wieder über einen Premix unter Einsatz des Premix-Membranemulgierens erfolgen. Auf diese Weise sind nicht nur Emulsionen unterschiedlicher Viskosität, sondern auch Mikrogele mit eingeschlossenen hydrophoben oder hydrophilen Komponenten herstellbar.
Mikrofluidik-Technik
Die Bildung von Tropfen definierter Größe und enger Tropfengrößenverteilung wird durch die Mikrofluidik-Technik ermöglicht, von der nachstehend verschiedene Varianten vorgestellt werden. Obwohl die Tropfenbildung mittels Membranen zu den mikrofluidischen Systemen gehört, wird hier unter Mikrofluidik-Technik das Emulgieren „on a Chip“ mit definierten Mikrokanälen verstanden.
Die Träger für die Mikrokanäle können z. B. Si-Chips sein oder aus Edelstahl, Polycarbonat, Polydimethylsiloxan, Polymethylmethacrylat oder thermoplastischen Polyester bestehen.
Tropfenbildung mit parallelen Einzelkanälen
Hierfür werden zur Tropfenbildung Mikrokanäle mit unterschiedlicher Gestaltung der Kanalanordnung und des Kanalauslaufs auf Chips aufgebracht. Gegenüber dem Membranemulgieren (mikroporöses Glas, Keramik oder Sinterglas) sind hier die Mikrokanäle definiert gestaltet. Die Tropfenbildung erfolgt spontan und mit erheblich geringerem Flux bzw. bei geringer Druckdifferenz. Der Energieaufwand zur spontanen Tropfenbildung der Ölphase beträgt z. B. 3,5 J/kg [10]. Für eine hohe Produktivität sind viele Chips (z. B. Größe bis 101 x 101 x 0,5 mm) mit hoher Tropfenbildneranzahl erforderlich. Zu den wesentlichen Parametern für eine gleichmäßige Tropfenbildung gehören die Fließgeschwindigkeit und Druckdifferenz (Dispersphase) sowie die Grenzflächenspannung zwischen den Phasen.
Der Tropfengrößenbereich der erzeugten Mikrogele, O/W- und W/O-Tropfen liegt allgemein oberhalb 5 µm. Zur Bildung von definierten Doppelemulsionen wird überwiegend eine feindispergierte W/O-Phase vertropft.
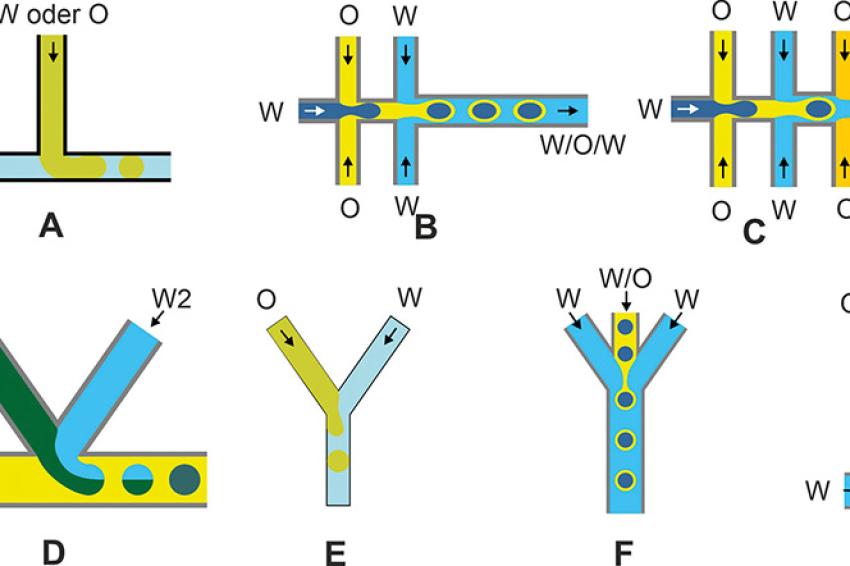
Beispiele für die Gestaltung der Mikrokanäle zur Tropfenbildung zeigt Abb. 3. Eine ausführliche Beschreibung dieser Mikrokanalsysteme ist in [4] zu finden. Während im System A (Abb. 3) beim Erzeugen einer O/W-Emulsion mit nur 1 L m-2h-1 (Tropfengröße 10 µm) ein sehr geringer Durchsatz erzielt wird, kann bei der Variante B der Durchsatz 2,7 m3m-2h-1 betragen (Tropfendurchmesser 30 µm). Mit der Variante C - als Millipede-System bezeichnet – ist ein Durchsatz von 11 m3m-2h-1 möglich (Tropfengröße 75 µm [14]).
Tropfenbildung mit dem EDGE-System
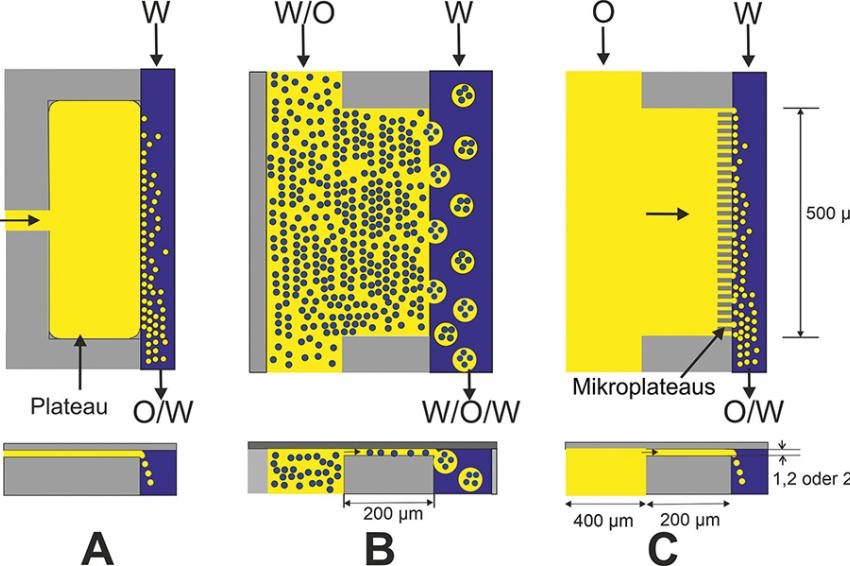
Das EDGE-System (Edge-based Droplet Generation) ist ein Ergebnis der Optimierung des Systems A (Abb. 3). Hier wurde die Geometrie der Terrasse (jetzt Plateau) mehrfach modifiziert. Varianten der Plateaugestaltung werden in Abb. 4 gegenübergestellt: Während bei A die Dispersphase durch einen Mikrokanal zum breiten Plateau gelangt, wird diese bei B direkt vom breiteren Kanal dem Plateau zugeführt. Durch zusätzliche „Mikroplateaus“ (C) wird mit diesem modifizierten Plateau das Vertropfen niedrig- und höherviskose Dispersphasen durch Variieren des Differenzdruckes erleichtert (Tropfengrößen 6-18 µm bei < 0,1MPa, > 28 µm bei 0,1-0,3 MPa [15]). Mit der Variante B wurde z. B. eine W/O-Emulsion mit Sonnenblumenöl in Magermilch dispergiert [17].
Zuführung der Phasen in Mikrokanal-Junction
Eine weitere Variante für die Tropfenbildung ist das Vertropfen der Dispersphasen in untereinander verbundene bzw. sich kreuzende Mikrokapillaren (Junction auf Chips oder in 3D-Modulen) in die kontinuierliche Phase. Bei O/W-Systemen erfolgt die Tropfenbildung in hydrophilen Kapillaren. Neben der Bildung von O/W- und W/O-Systemen ist die Bildung von Doppelemulsionen und multiplen Emulsionen über die Kombination der Junction möglich.
Im Gegensatz zu den oben beschriebenen Verfahren können hiermit Einzeltropfen in Einzeltropfen und somit auch hydrophobe oder hydrophile Phase um einen Tropfen bzw. unterschiedliche Kapseln gebildet werden. Auf diese Weise können Phasen vertropft werden, die als Einzeltropfen oder als Tropfenhülle gelartige oder feste Strukturen bilden. Beispiele für die Gestaltung bzw. den möglichen Verlauf von Mikrokanälen für hydrophile und hydrophobe Phasen zeigt Abb. 5.
Somit können über einen speziellen Verlauf der Mikrokanäle und über die Bildung eines Einzeltropfens, der einen eingeschlossenen Einzeltropfen enthält, verschiedene Phasen in einem Tropfen untergebracht bzw. Einzeltropfen verkapselt werden (Abb. 5, Varianten B und C). Auf diese Weise ist durch Kombination von - mit T-Junction auch der gleichzeitige Einschluss verschiedener Enzyme für biotechnologische Prozesse möglich [20]. Zur Bildung von Polymer-Mikrogelen kann die zweite W-Phase eine Vernetzerlösung enthalten (Abb. 5; D, G).
Auf einem Si-Chip (101 x 101 mm) können bis zu 10.260 Tropfenbildner untergebracht werden (-Junction, Kanäle 10 x 18 µm), mit denen Mikropartikel (
8 – 16 µm) erzeugbar sind (Durchsatz pro Chip ~2 L/h, [21]). Inzwischen werden auch 3D-Polymethylmethacrylat-Module mit T-Junction erzeugt (2.048 Tropfenbildner pro cm2 [22]).
Tropfenbildung mittels Mikrodüsen in koaxialen Kanälen
In Abb. 1 sind unter C und F Beispiele für multiple Emulsionen enthalten, deren Bildung einen höheren Aufwand erfordern. Hierfür eignen sich Mikrodüsen in koaxialen Mikrokanälen. Ebenso wie mit Doppel-T-Junction oder -Junction können hiermit Nutrazeutikal in Doppel- und multiple Emulsionen eingeschlossen werden (Abb. 6, A). Der Vorteil der koaxialen Mikrokanäle besteht darin, dass hiermit gleichzeitig zwei oder mehrere Stoffe, die sich gegenseitig beeinflussen, in einen Tropfen eingeschlossen werden können (Abb. 1, F; Abb. 6, B).
Bei diesem System wird die erzeugte Tropfengröße – wie bei den verschiedenen Mikrokanal-Junctions – durch die Fließgeschwindigkeit der Phasen, Grenzflächenspannung und dem Viskositätsverhältnis zwischen den Phasen bestimmt. Über die Gestaltung der Düsen und den Unterschied in der Fließgeschwindigkeit zwischen innerer und mittlerer Phase kann auch die Anzahl der inneren Tropfen in der mittleren Phase eingestellt werden (z. B. Einschluss bis 400 Tropfen in einem größeren Tropfen [26]). Die erzeugten Tropfen weisen z. B. einen Durchmesser von 25 µm oder auch 300 µm auf. Derartige Kapillardüsen in Mikrokanälen bieten sich insbesondere zum Einschluss spezieller Zusatzstoffe in Mikrokapseln an.
Zusammenfassung und Resümee
Das Membranemulgierverfahren und die Mikrofluidik-Technik gestatten eine schonende bzw. mit geringem Energieeintrag durchgeführte Herstellung von Emulsions- und Verkapselungssystemen. Während das Premix-Membranemulgieren einen hohen Flux (z. B. 60 m3m-2h-1[7]) ermöglicht, ist die Produktivität der Mikrofluidik-Technik bezogen auf Tropfenbildner pro Quadratmeter teilweise erheblich geringer. Aufgrund der hohen Anzahl von möglichen EDGE-Modulen pro Kubikmeter Raumvolumen können z. B. mit 1 m3-EDGE-Modulen ~3 m3 O/W Emulsion (6/94) pro Stunde erzeugt werden [17]. Beim Einsatz der Mikrofluidik-Technik ist somit in die ökonomische Betrachtung das benötigte Raumvolumen für die Module einzubeziehen.
Zu den Herausforderungen bei der Einführung der Mikrofluidik-Technik gehören die Verbesserung der Ökonomie und die Verfügbarkeit geeigneter homogener Flüssigphasen (frei von Mikropartikeln), die gut in den erforderlichen Fließeigenschaften einstellbar sind. Weiterhin ist u. a. eine periodische Selbstreinigung der Module erforderlich. Die Grenzflächenspannung zwischen den Phasen und deren Viskositätsverhältnis sollte unter Einsatz natürlicher Stoffe definiert einstellbar sein.
Der gegenwärtige Trend bei der Einführung der Mikrofluidik-Technik z. B. in der medizinischen Diagnostik und chemischen Analyse, Impfstoffherstellung (insbesondere Liposomenbildung), Erzeugung von Gefahrstoffen (Bioalkohol) und speziellen Pharmaka lässt hoffen, dass in der Food-Branche diese Technologie nicht nur für die Emulsionsbildung, sondern auch als Mikromischtechnik für flüssige Medien [27] sowie für die Lebensmittelkontrolle [3] stärker in den Fokus rückt.
Literatur
[1] Meštrović, T., Nutraceutical Regulation, https://www.news-medical.net/health/Nutraceutical-Regulation.aspx Abrufdatum 07.01.2022.
[2] Chopra, A.S. et al. (2022), Pharmacological Res. 175, 106001.
[3] Logesh, D. et al. (2021), Trends in Food Sci. & Technol. 116, 501.
[4] Muschiolik, G. (Hrsg.) Multiple Emulsionen, Herstellung und Eigenschaften.
2. Auflage, Behr´s Verlag Hamburg, 2022.
[5] Vladisavljević, G.T. (2016), Particuology 24, 1.
[6] Alliod, O. et al. (2018), Colloids and Surfaces A 557, 76.
[7] Mugabi, J. et al. (2021), Colloids and Surfaces A 630, 127560.
[8] Kukizaki, M. et al. (2009), Chemical Engin. J. 151, 387.
[9] Hornig, N. and Fritsching, U. (2016), J. of Membrane Sci. 514
[10] Sugiura, S. et al. (2001), J. of Chem. Engin. of Japan 35, 757.
[11] van Dijke et al. (2008), Langmuir 24, 10107.
[12] Vladisavljević, G.T. et al. (2018), Chem. Engin. J. 33, 380.
[13] Kobayashi, I. and Ichikawa, S. (2015), Japan J. of Food Engin., 16, 89.
[14] Amstad, E. et al. (2016), Lab on a Chip 16, 4163.
[15] Klooster, S.t. et al. (2019), Scientific Reports 9, 7820.
[16] van Dijke, K. et al. (2010), Soft Matter 6, 321.
[17] van Dijke, K. et al. (2010), J. of Food Engin. 97, 348.
[18] Sahin, S. and Schroën, K. (2015), Lab Chip, 15, 2486.
[19] Vladisavljević, G.T. et al. (2013), Adv. Drug Delivery Rev. 65, 1626.
[20] dos Santos, E. et al., (2020), Advanced Materials 2004804.
[21] Yadavali, S. et al. (2018), Nature Communications 9, 1222.
[22] Gelin, P. et al. (2020), Ind. & Engin. Chemistry Res. 59, 12784.
[23] Chen, H. et al. (2011), Soft Matter 7, 2345.
[24] Adams, L.L.A. et al. (2012), Soft Matter 8, 10719.
[25] Hou, L. et al. (2017), Microfluid Nanofluid 21, 60.
[26] Leister, N. et al. (2022), J. of Colloid and Interface Sci. 611, 451.
[27] Webb, C. et al. (2020), Intern. J. of Pharmaceutics 582, 119266.