Hanföl in die Pfanne?
Qualitätskontrolle mit einem Shimadzu GCMS-QP2020 NX Single-Quadrupol-Massenspektrometer
Fette und Öle liefern die höchste Energiedichte in unserer Nahrung und spielen eine wichtige Rolle hinsichtlich der Textur, des Aromas und des Mundgefühls. Hanföl im Besonderen hat einen hohen Anteil der mehrfach ungesättigten α-und γ-Linolensäure. Das macht das Öl ernährungsphysiologisch wertvoll, jedoch schnell verderblich. Das wird deutlich an der Mindesthaltbarkeit, die bei Hanfölen in der Regel nur sechs Monate beträgt – im Gegensatz zu Olivenölen, bei denen bis zu zwei Jahren möglich sind. Hanföl sollte dunkel und kühl gelagert, rasch verbraucht und nicht zu stark erhitzt werden. Demnach scheint es sich nicht zum Backen und Braten zu eignen. Was aber passiert bei erhöhten Temperaturen mit dem Öl?
Hanföl wird aus den Samen der Pflanze Cannabis Sativa L kalt gepresst. Bereits vor Christi Geburt wurde Cannabis als Nutzpflanze verwendet. Durch viele Restriktionen während des 20. Jahrhunderts gerieten ihre Qualitäten in vielerlei Hinsicht in Vergessenheit. Erst mit den gesetzlichen Lockerungen und Änderungen der letzten Jahre erfährt Hanf einen neuen Hype, so auch als Hanföl.
Die Hanfsamen sind vollgepackt mit Speicherstoffen wie hochwertigen Ölen, Proteinen, Kohlenhydraten sowie mit wichtigen Mineralstoffen und Spurenelementen, Vitaminen und einigen Aromastoffen. Sie haben einen ernährungsphysiologisch hohen Wert und können direkt verzehrt werden.
Die Samen enthalten kein psychoaktives THC (Tetrahydrocannabinol). Lediglich durch anhaftendes Harz oder die Kontamination mit Blättern kann es im Prozess der Weiterverarbeitung in das fertige Produkt gelangen. Die Konzentrationen sind dann so gering, dass es in den meisten Fällen kein Problem darstellt. Dennoch sind neben den typischen Parametern für Speiseöl die Cannabinoide ein Gradmesser der Qualitätskontrolle. Ihr Gehalt gibt einen entscheidenden Einblick in die Güte der Verarbeitung.
Qualitätsbestimmung mit dem Oxidationsstatus
Der gängigste Parameter zur Qualitätsbestimmung von Speiseölen ist der Oxidationsstatus des Öls, der sich über eine Reihe analytischer Kennzahlen beschreiben lässt. Zu den gebräuchlichsten gehören die Säurezahl, die Peroxidationszahl (frühes Stadium der Oxidation) und die Anisidinzahl (fortgeschrittene Oxidation). Die Ranzigkeit des Fettes leitet sich aus der Oxidationsstabilität ab. Dazu gibt es die Active Oxygen Methods (AOM), bei denen das Fett erhöhten Temperaturen in einem Luftstrom ausgesetzt wird (vergl. Swift- oder Rancimat-Methode).
Da keine dieser Kennzahlen allein geeignet ist, die Oxidation des Produkts zu beschreiben, gibt es verschiedene Versuche, Marker zu definieren, die den Oxidationsstatus beurteilen. Dazu zählen vor allem verschiedene Aldehyde und Ketone [1-6]. Das länderübergreifende Oleum-Projekt der EU (www.oleumproject.eu) nennt mehrere Marker für Olivenöl, die aber nur im Set geeignet sind, bspw. einen ranzigen sensorischen Eindruck messtechnisch zu erfassen.
Die Fettsäuren der Lipide oxidieren bereits während der Lagerung, aber insbesondere bei nicht sachgemäßer Verarbeitung. Die Oxidationsgeschwindigkeit steigt dabei mit der Anzahl der ungesättigten Kohlenstoffbindungen. Der Abbau der Fettsäuren erfolgt in der Frucht über die Lipoxygenase-Kaskade und liefert bevorzugt C6-Komponenten [7]. Dies führt zu einer Abnahme des Fettsäuregehalts im Produkt und dabei zu einem erheblichen Anstieg der volatilen kurzkettigen Komponenten, wie z. B. Aldehyde, Ketone, Ester und Alkohole [8].
Öle mit einem hohen Anteil ungesättigter Fettsäuren sind besonders anfällig für die Oxidation. Ein Anstieg der Hexansäure im Olivenöl konnte von Cecchi et al. auch bereits unter milden Lagerungsbedingungen bei Raumtemperatur im Dunkeln mit geöffnetem Deckel festgestellt werden [10]. Die Lipolyse ist ein natürlicher Vorgang, der schon in der Frucht beginnt. Die oxidativen Prozesse kommen aber erst nach der Ernte in Gang, vor allem bei der Lagerung des Öls, und sind die Ursache für unerwünschte Fehlaromen. Im Olivenöl wird häufig die Zunahme an Hexanal und Nonanal als Marker für ein ranziges Produkt beschrieben. Jedoch ist Hexanal auch in frischen Ölen hoher Qualität (bspw. extra virgin) nachzuweisen und unterliegt saisonalen Schwankungen [9].
Material und Methoden
Für die Untersuchung wurden fünf kaltgepresste Bio-Hanföle lokal bezogen. Als GC-MS kam ein Shimadzu GCMS-QP2020 NX Single-Quadrupol-Massenspektrometer mit Headspace-Probengeber HS-20 zum Einsatz.
10 µl einer Öl-Probe wurden in ein 10 ml Headspace-Vial pipettiert, luftdicht verschlossen und für die Alterungsversuche im HS-Ofen bei 150 °C unterschiedlich lang inkubiert. Als chromatographische Trennsäule diente eine SH-Rxi 624 Sil MS mit 20 m Länge, 0,18 mm Innendurchmesser und einer Filmdicke von 1 µm. Die Daten wurden im Full Scan aufgezeichnet mit einem Massenbereich von m/z 10 – 400.
Für die Bestimmung der Cannabinoide wurde der Cannabis Analyzer von Shimadzu verwendet, bestehend aus der kompakten HPLC i-Series mit UV-Detektion. Die Trennung fand auf einer Shim-pack XR ODS II C18 Säule statt mit Wasser und Methanol als Eluenten und einer Detektionswellenlänge von 220 nm. Die Proben wurden nach Extraktion mit Isopropanol in Methanol gelöst und anschließend durch Spritzenvorsatzfilter in Standard HPLC-Vials filtriert. Die externe Kalibration erfolgte von 5 bis 100 ppm und 5 Standardlösungen.
Die Qualität des Hanföls
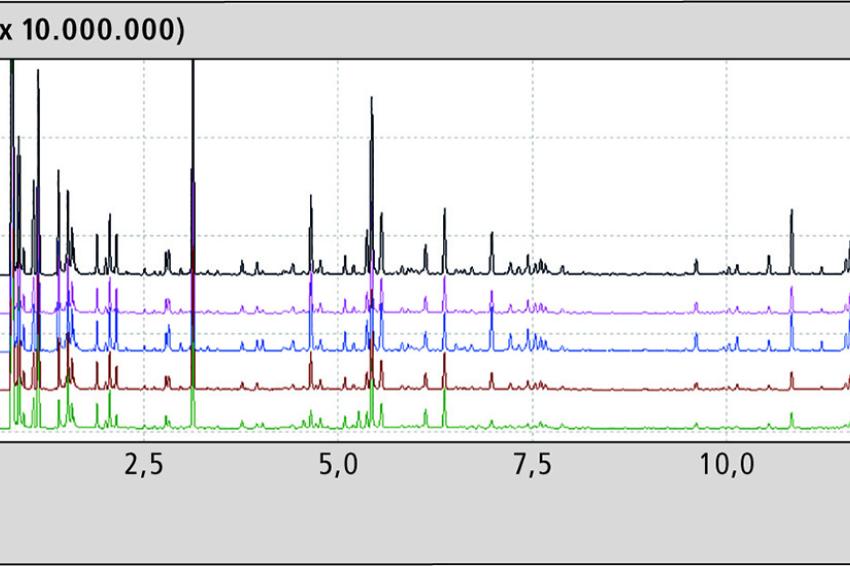
In dem Experiment wurden die Aromaprofile von fünf verschiedenen Hanfölen mittels Headspace-GC-MS aufgezeichnet. Die Hanföle wurden bei 0,5/1,5 und 2,5 Stunden bei 150 °C im Dunkeln inkubiert. Abb. 1 zeigt das Aromaprofil der fünf Hanföle im Overlay vor der Inkubation.
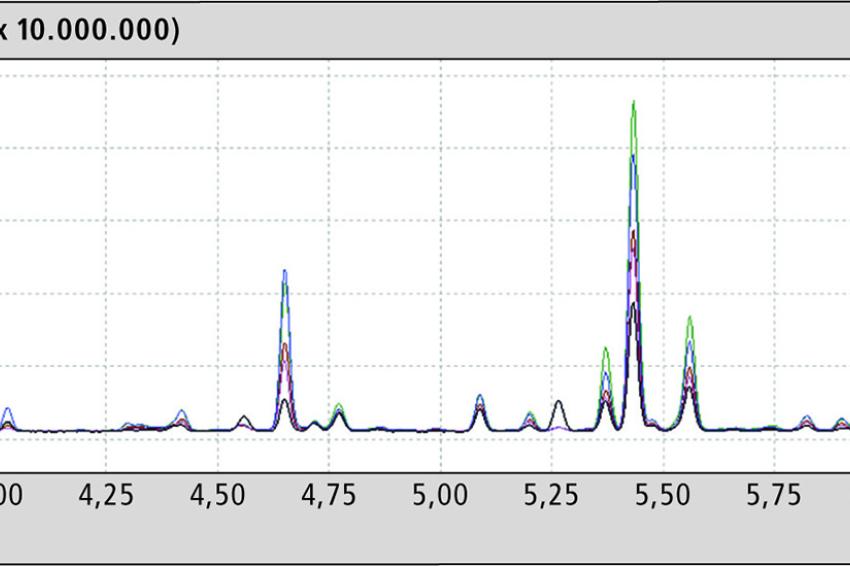
Die flüchtigen Komponenten, die dabei erfasst werden, sind sehr gut vergleichbar und in den einzelnen Ölen fast identisch. Bei genauerer Betrachtung erkennt man aber deutliche Unterschiede in der Konzentration einiger Komponenten (Abb. 2).
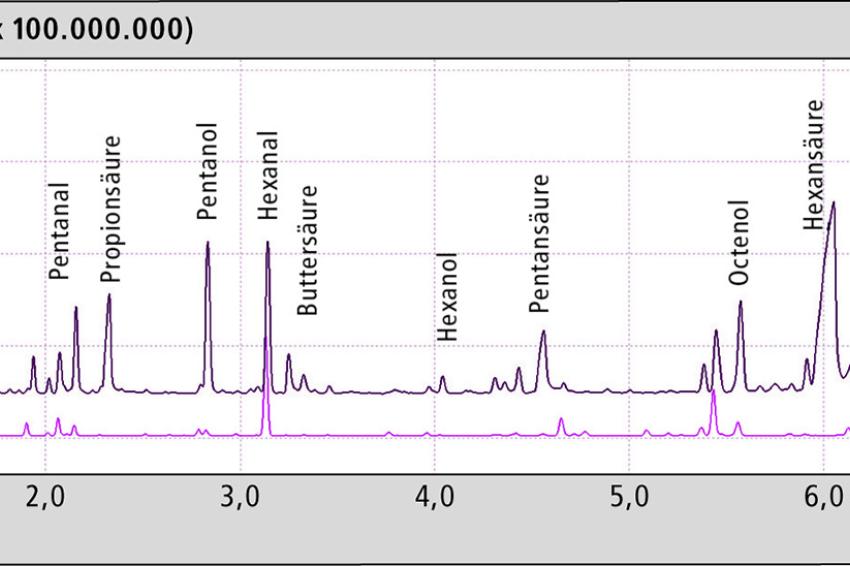
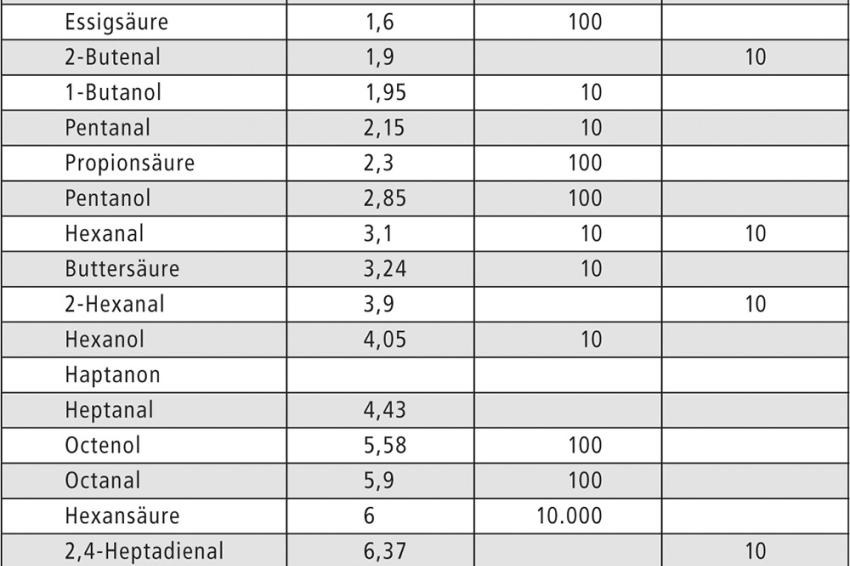
Interessanterweise sind bei zwei Hanfölen auch Terpene nachweisbar. Das ist deswegen ungewöhnlich, da die Terpene in der Blüte und den Blättern der Pflanze vorkommen, nicht aber in den Samen, aus denen die Hanföle gewonnen werden. Nach der Thermooxidation zeigte sich ein starker Anstieg der Anzahl und Konzentration der flüchtigen Komponenten (Abb. 3). Einige Signale gehen auch zurück. Tabelle 1 gibt einen Überblick über die Komponenten, die sich deutlich verändern.
Interessanterweise erwies sich in den untersuchten Hanfölen gerade Hexanal als relativ stabil gegenüber der Thermooxidation. Bei einigen Ölen war ein leichter Anstieg, bei anderen eine leichte Abnahme messbar (vergl. Tab. 1). Selbst nach 2,5 h der Thermooxidation bei 150 °C ist Hexanal nur wenig verändert.
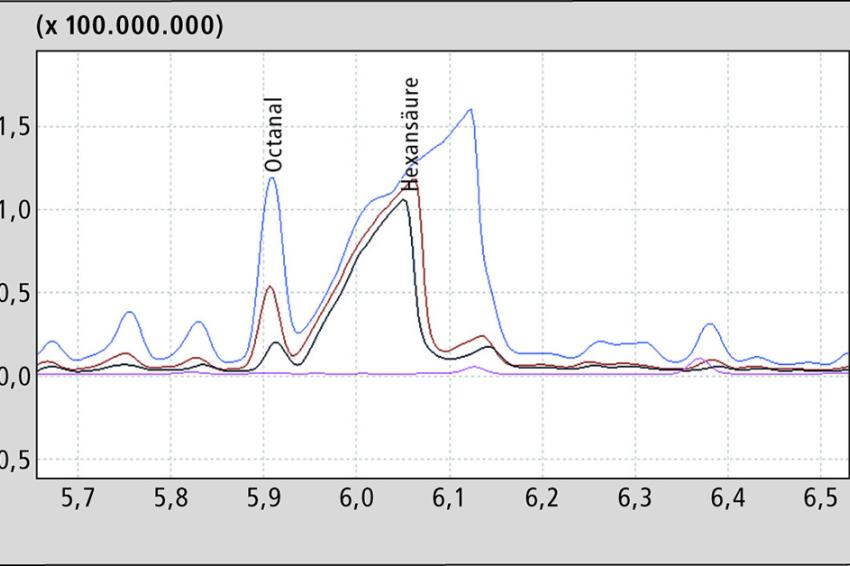
Deutlicher ist die Zunahme bei den kleinen Säuren und Alkoholen; die stärkste ist bei der Hexansäure zu detektieren. In Abb. 4 ist ein Hanföl ohne und nach Thermooxidation (0,5 h/1,5 h/2,5 h) gezeigt. Gerade die kurzkettigen Fettsäuren sorgen für ein ranziges Aroma und machen das Produkt umgehend ungenießbar.
Der Grund für den starken Anstieg dieser Säuren dürfte in den Reaktionsbedingungen des Experiments liegen. Hexanal wird durch die hohen Temperaturen relativ zügig zur entsprechenden Hexansäure oxidiert. Das verdeutlicht die Empfehlung, dass Öle mit mehrfach ungesättigten Fettsäuren nicht übermäßig stark erhitzt werden sollten.
Bestimmung der Cannabinoide
Für die Bestimmung der Cannabinoide wurde zu Beginn eine Kalibration mit den gängigsten Varianten gemessen, exklusive der THC-Derivate. Jede Kalibration erreichte ein Bestimmtheitsmaß von mindestens 0.999. Es wurden die reinen Hanföle und die nach der zuvor erwähnten Prozedur künstlich gealterten Sorten gemessen. Jedes Hanföl entsprach den geltenden Regularien. Es waren keine Cannabinoide nachweisbar, jedoch kann es durch den Verarbeitungsprozess zu ihren Einträgen kommen. Dies war bei den fünf gemessenen, kommerziell erhältlichen Ölen nicht der Fall.
Fazit
Hanföl kann als ernährungsphysiologisch wertvolles Öl betrachtet werden. Es enthält einen hohen Anteil der mehrfach ungesättigten α-und γ-Linolensäure und ist damit vergleichbar mit Leinöl. Öle verderben rasch aufgrund der schnellen Oxidation der Fettsäuren und sollten nicht zum Braten und Backen genutzt werden. Wegen des hohen Anteils der ungesättigten Fettsäuren kommt es schnell zu Rauchentwicklung und Zersetzung.
Die Suche nach geeigneten Markern, um verlässlich den Alterungszustand zu beurteilen, gestaltet sich schwierig. In einigen Arbeiten wird für Olivenöl Hexanal vorgeschlagen [1]. Hexanal zeigte sich aber im Hanföl bei den Untersuchungen als relativ stabil, selbst gegenüber den extremen Bedingungen der Thermooxidation bei 150 °C. Hexanal ist somit ungeeignet als Marker für thermooxidative Prozesse im Hanföl.
Eindrucksvoll ist der Anstieg der Hexansäure bei den gewählten Bedingungen. Inwieweit sie als Marker für Alterungsprozesse im Hanföl taugt, muss aber noch gezeigt werden. Bisher ist sie bekannt, ein weit fortgeschrittenes Stadium der Alterung anzuzeigen, da sie extrem ranzig riecht. Von daher bedeuten Spuren von Hexansäure in der Regel, dass das Produkt ungenießbar geworden ist.
Cannabinoide konnten in den ausgesuchten Hanfölen nicht nachgewiesen werden. Das spricht für eine sorgsame Verarbeitung des Produkts. Da als Drogenhanf verwendet, haftet Cannabis ein negatives Image an. Dies liegt vor allem am einzigen psychoaktiven Cannabinoid THC. Dieser Wirkstoff ist jedoch nicht in den Samen enthalten, weshalb das Hanföl zu Unrecht verrufen ist.
LITERATUR
[1] Jaeho HA,*† Dong-Won SEO,* Xi CHEN Determination of Hexanal as an Oxidative Marker in Vegetable Oils Using an Automated Dynamic Headspace Sampler Coupled
to a Gas Chromatograph/Mass Spectrometer ANALYTICAL SCIENCES SEPTEMBER 2011, VOL. 27
[2] Hrncirik, K.; Fritsche, S. Comparability and reliability of different techniques for the determination of phenolic compounds in virgin olive oil. Eur. J. Lipid Sci. Technol. 2004, 106, 540-549
[3] Velasco, J.; Dobarganes, C. Oxidative stability of virgin olive oil. Eur. J. Lipid Sci. Technol. 2002, 104, 661-676
[4] Rastrelli, L.; Passi, S.; Ippolito, F.; Vacca, G.; De Simone, F. Rate of degradation of R-tocopherol, squalene, phenolics, and polyunsaturated fatty acids in olive oil during different storage conditions. J. Agric. Food Chem. 2002, 50, 5566-5570
[5] Pagliarini, E.; Zanoni, B.; Giovanelli, G. Predictive study on Tuscan EVOO stability under several commercial conditions. J. Agric. Food Chem. 2000, 48, 1345-1351
[6] Ceballos, C.; Moyano, M. J.; Vicario, I. M.; Alba, J.; Heredia, F. J. Chromatic evaluation of virgin olive oils submitted to an accelerated test. J. Am. Oil Chem. Soc. 2003, 80, 257-262.
[7] Olıias, J. M.; Pe´rez, A. G.; Rı ´os, J. J.; Sanz, L. C. Aroma of virgin olive oil: Biogenesis of the “green” odor notes. J. Agric. Food Chem. 1993, 41, 2368-2373.
[8] Snyder, J. M.; Frankel, E. N.; Selke, E.; Warner, K. Comparison of gas chromatographic methods for volatile lipid oxidation compounds in soybean oil. J. Am. Oil Chem. Soc. 1988, 65, 1617-1620.
[9] M. T. Morales, J. J. Rios, and R. Aparicio Changes in the Volatile Composition of Virgin Olive Oil during Oxidation: Flavors and Off-Flavors J. Agric. Food Chem. 1997, 45, 2666-2673
[10] Lorenzo Cecchi,†,‡ Marzia Migliorini, Elisa Giambanelli, Adolfo Rossetti, Anna Cane and Nadia Mulinacci New Volatile Molecular Markers of Rancidity in Virgin Olive Oils under Nonaccelerated Oxidative Storage Conditions J. Agric. Food Chem. 2019, 67, 13150-13163